KORT
Gastro-oesofageale reflux (GERD) is een frequent voorkomende chronische aandoening die wordt gekenmerkt door hinderlijke symptomen veroorzaakt door terugvloeiing van maaginhoud tot in de slokdarm. Overgewicht verhoogt het risico op gastro-oesofageale refluxsymptomen en oesofagitis door toename van de abdominale druk. Er is behoorlijk goede evidentie voor een gunstig effect van vermageringsadvies bij GERD-patiënten met overgewicht of centrale vetopstapeling. De raad om late avondmaaltijden te vermijden is eveneens wetenschappelijk gefundeerd. Eet ten laatste drie uur voor bedtijd. Over de volgende aspecten is de wetenschappelijke evidentie beperkt of controversieel: de grootte en het vetgehalte van de maaltijd, het gebruik van alcohol, koffie en zure en koolzuurhoudende dranken. Over chocolade, pikant voedsel en uien zijn er geen nadelige effecten bekend, tenzij anekdotisch.
Sinds de beschikbaarheid van krachtige zuurremmende protonpompinhibitoren (PPIs) is het belang van voedingsmaatregelen bij de behandeling van gastro-oesofageale reflux in de dagelijkse klinische praktijk afgenomen. Individueel aangepast voedingsadvies kan echter toch helpen bij bepaalde patiënten.
Gastro-oesofageale reflux (gastro-esophageal reflux disease of GERD) is een chronische aandoening die wordt gekenmerkt door hinderlijke symptomen veroorzaakt door terugvloeiing van maaginhoud tot in de slokdarm (Montreal consensus-definitie) (1). Typische slokdarmgerelateerde GERD-klachten zijn pyrosis (een branderig gevoel achter het borstbeen, vaak opstijgend) en regurgitatie (terugvloei van zure maaginhoud tot in de mondholte of een gevoel van opwaartse beweging van maaginhoud achter het borstbeen). In sommige gevallen treden eerder atypische, slokdarmgerelateerde symptomen op de voorgrond, zoals thoracale pijn of dysfagie (moeilijkheden bij het slikken), of er ontstaan symptomen buiten de slokdarm (extra-oesofageale symptomen), zoals heesheid, keelpijn en een kropgevoel in de keel. Bij dergelijke atypische klachten is het een hele uitdaging voor de arts om de juiste diagnose te stellen omdat ook andere oorzaken, bijvoorbeeld postnasale drip of long- en luchtwegaandoeningen, deze symptomen kunnen uitlokken.
Bij slechts ongeveer 40 % van de patiënten veroorzaakt de blootstelling van de distale slokdarm aan maagzuur endoscopisch zichtbare letsels van het slokdarmslijmvlies (oesofagitis). Klachten ten gevolge van reflux zonder oesofagitis worden ondergebracht in de categorie NERD of ‘non-erosive reflux disease’. In geval van twijfel over de diagnose van GERD in afwezigheid van oesofagitis kan een 24 uur-pH-meting met of zonder impedantiemetingen in de slokdarm uitsluitsel geven.
Prevalentie
GERD is een frequente aandoening. In een recente systematische review van epidemiologische studies rapporteerden 15,2 % van de ondervraagde personen in Europa wekelijks klachten van pyrosis en/of regurgitatie (bereik 8,8 % - 25,9 %) (2). Reflux komt frequenter voor in de Verenigde Staten (20 %) en in mindere mate in Azië (ongeveer 5 %). Er is wereldwijd een duidelijk stijgende trend aan de gang van GERD. Studies uitgevoerd na 1995 stellen 50 % meer prevalentie vast dan oudere studies. Deze evolutie is vermoedelijk gedeeltelijk te verklaren door de epidemische toename van obesitas.
Algemene behandeling
Protonpompinhibitoren (PPIs) vormen de hoeksteen van de behandeling van GERD. Zij verlagen de zuurtegraad van de maaginhoud. PPIs hebben weinig nevenwerkingen, genezen oesofagitis en zorgen voor een adequate symptoomcontrole bij de meerderheid van de patiënten. Toch is er een substantiële groep patiënten (tot 30 %) die ondanks maximale behandeling met PPIs nog altijd symptomen ervaart.
Pathofysiologie
De pathofysiologie van GERD is complex en multifactorieel. De voornaamste spelers zijn enerzijds kortdurende relaxaties van de sluitspier of sfincter tussen de slokdarm en de maag (“transient relaxations of the lower esophageal sphincter” of TLESRs) en anderzijds een maaghernia waardoor de onderste slokdarmsfincter zich boven en niet ter hoogte van de diafragmakoepels bevindt. Hierdoor verloopt het afsluitmechanisme minder efficiënt (3). De sfincter is de belangrijkste barrière tegen reflux (Figuur 1). Voedingsbestanddelen zoals vet, chocolade, koffie, citrusvruchten, alcohol en koolzuurhoudende dranken worden sinds lang geassocieerd met het optreden van GERD. Het achterliggende mechanisme zou een verminderde druk ter hoogte van de onderste slokdarmsfincter zijn (4). Obesitas kan reflux bevorderen door toename van de abdominale druk.
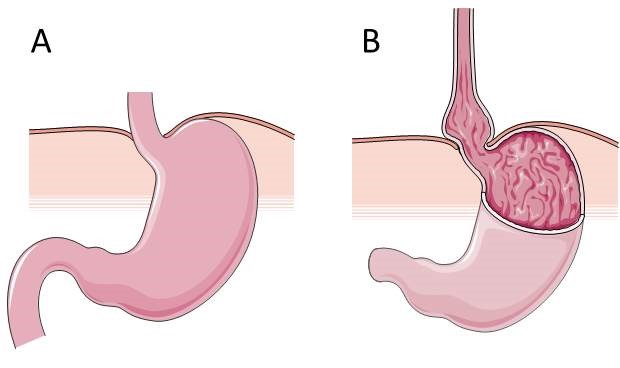
Figuur 1:
A: Normale anatomie waarbij de overgang tussen de slokdarm en de maag zich ter hoogte van de diafragmakoepels bevindt.
B: Maaghernia waarbij de overgang tussen de slokdarm en de maag, en bijgevolg ook de onderste slokdarmsfincter, zich boven het diafragma bevindt.
Obesitas
In een grote meta-analyse met in totaal 18.346 patiënten was de kans op refluxgerelateerde symptomen en oesofagitis 1,57 (odds ratio) keer hoger bij patiënten met overgewicht (body mass index (BMI) 25-29,9 kg/m2) en 2,15 keer hoger bij obese patiënten (BMI ≥ 30 kg/m2) (5). Een recente studie vond bovendien een associatie tussen enerzijds oesofagitis, een Barrett slokdarm (aandoening waarbij het slokdarmslijmvlies onder invloed van reflux lokaal is omgevormd tot darmslijmvlies wat op termijn kan evolueren tot kanker) en slokdarmkanker en anderzijds centrale vetstapeling (hogere taille-omtrek, toegenomen verhouding taille-tot-heup-omtrek) en dit onafhankelijk van de BMI (6). De gerapporteerde achterliggende mechanismen zijn toegenomen druk in de maag door abdominaal overgewicht en een hiermee gepaard gaande grotere maagslokdarmdrukgradiënt alsook een maaghernia met een opwaartse verplaatsing van de onderste slokdarmsfincter tot gevolg (Figuur 1) (7). Obesitas is bovendien geassocieerd met een toegenomen frequentie van TLESRs na de maaltijd (8). Deze associaties werden bevestigd in een studie bij asymptomatische vrijwilligers waarbij door middel van een strakke buikgordel de abdominale druk werd verhoogd wat aanleiding gaf tot een kleine maaghernia en zure reflux in de distale slokdarm (9). In een andere recente studie waarin twee cohorten patiënten vijf jaar werden gevolgd, bleek gewichtstoename na vijf jaar eveneens geassocieerd met het optreden van typische refluxsymptomen (10).
Vermageringsadvies
Er is behoorlijk goede evidentie voor een gunstig effect van vermageringsadvies bij GERD-patiënten met overgewicht of centrale vetopstapeling. De HUNT-studie is een grootschalig Noors bevolkingsonderzoek dat alle inwoners ouder dan 20 jaar in Nord-Trøndelag County via een enquête heeft bevraagd in 1995-1997 en in 2006-2008 (11). Personen met een BMI-daling van meer dan 3,5 eenheden over een periode van ongeveer 10 jaar hadden bijna 2 keer meer kans op het wegblijven van refluxsymptomen wanneer ze geen antirefluxmedicatie gebruikten en 4 keer meer kans wanneer ze deze medicatie minstens op wekelijkse basis gebruikten. Gelijkaardige resultaten werden gerapporteerd in “The Nurses’ Health”-studie, een observationele cohortstudie bij 10.545 vrouwen (12). In drie Nederlandse gerandomiseerde placebogecontroleerde studies die gewichtsverlies door een maagballon hebben onderzocht, leidde gewichtsverlies tot minder zuurblootstelling in de slokdarm (13-15). Een studie die bij 332 obese patiënten een gestructureerd dieetprogramma vergeleek met een telefonische begeleiding, vond eveneens een gunstig effect op zowel de prevalentie van reflux (daling van 37 tot 15 %) als op de ernst van de symptomen na een BMI-reductie van gemiddeld 34,7 naar 30,2 kg/m2 (gewichtsdaling van 13 ± 7,7 kg) (16). Er trad een verbetering van GERD op vanaf 5 tot 10 % gewichtsverlies bij vrouwen en vanaf 10 % gewichtsverlies bij mannen. Dit gunstige effect van gewichtsverlies op GERD kon echter niet worden bevestigd door een kleinschalige gerandomiseerde studie (laagcaloriedieet versus controle bij 19 patiënten) en een bevolkingsonderzoek gebaseerd op gewichtsverlies gerapporteerd door de deelnemende personen (17,18).
Tijdstip, grootte en duur van de maaltijden
Aangezien de meeste refluxepisodes optreden tijdens de eerste drie uur na de maaltijd en er meer reflux is in liggende positie, wordt in het algemeen aangeraden om ten laatste drie uur voor bedtijd te eten (19,20). Hoewel de gegevens hierover eerder beperkt zijn, ondersteunt de beschikbare literatuur deze richtlijn toch grotendeels. Piesman en collega’s vergeleken het effect van een vroege (6 uur voor bedtijd) en een late (2 uur voor bedtijd) avondmaaltijd op objectieve refluxparameters en symptomen bij 30 patiënten met typische symptomen (21). De late avondmaaltijd leidde tot significant meer nachtelijke reflux (pH-monitoring: pH < 4) maar was in deze twee dagen durende studie niet geassocieerd met meer symptomen (21). In een Japanse case-controlstudie die 147 GERD-patiënten vergeleek met 294 gezonde personen, was een avondmaaltijd binnen de drie uur voor bedtijd geassocieerd met GERD (odds ratio 7,45) (22). Binnen de drie uur na het avondeten gaan slapen was eveneens de belangrijkste onafhankelijke risicofactor voor terugkeer van GERD-gerelateerde symptomen in een cohorte van 337 patiënten die werden opgevolgd nadat hun symptomen onder controle waren na een behandeling met PPI gedurende 1 tot 2 maanden (23).
Grotere maaltijden zorgen voor meer uitzetting van de maag en meer TLESRs en reflux. Daarom krijgen patiënten met GERD als onderdeel van hun dieetadvies vaak de raad om volumineuze maaltijden te vermijden. Hetzelfde aantal calorieën verdelen over zes kleinere maaltijden in plaats van over drie grotere (of vloeibare) maaltijden bleek bij 15 patiënten effectief minder klachten van reflux te geven en had een gunstige invloed op objectieve refluxparameters (24). In een andere kleine studie die de snelheid van eten vergeleek, vond men geen verschil in symptomen en refluxparameters tussen dezelfde maaltijd eten in 5 minuten of in 30 minuten (25).
Samengevat: er kan geadviseerd worden om late avondmaaltijden te vermijden. Er is slechts minimale evidentie voor het advies om de grootte van de maaltijd te beperken.
Vet
Vetrijke maaltijden vermijden wordt vaak geadviseerd. De data die deze aanbeveling rechtstreeks ondersteunen zijn nochtans eerder beperkt. Vetrijk eten is wel vaak geassocieerd met obesitas, een duidelijke risicofactor voor GERD. Hierdoor zijn epidemiologische studies minder geschikt om het effect van vet op GERD te onderzoeken en is de aparte bijdrage van vet tot symptoominductie minder goed gekend (26). Bij gezonde vrijwilligers verlaagde een vetrijke maaltijd de druk ter hoogte van de onderste slokdarmsfincter in vergelijking met een isocalorische vetarme maaltijd. Een vetarme maaltijd zou dus het optreden van reflux kunnen bevorderen (27). Dit effect kon echter niet worden bevestigd in andere gelijkaardige studies bij vrijwilligers en patiënten (28,29). Fox en collega’s hebben het effect van het vetgehalte (50 versus 25 % vet, isocalorisch) en van de calorie-inhoud (1000 versus 500 kcal, gelijk vetgehalte) onderzocht bij 15 patiënten (30). Het volume van de maaltijden werd constant gehouden. Zij stelden vast dat het aantal calorieën en niet het vetgehalte van de maaltijd gerelateerd was aan de zuurblootstelling van de slokdarm (gemeten met draadloze registratie). Bij het calorie-arme dieet was de zuurblootstelling ongeveer 40 % lager dan bij het calorierijke dieet. De frequentie van refluxsymptomen werd daarentegen bepaald door het vetgehalte en minder door de calorie-inhoud (30). De kans dat een refluxepisode gepaard ging met symptomen was groter bij een vetrijk dieet. Deze bevindingen suggereren dat de sensitiviteit van de slokdarm voor blootstelling aan zuur verhoogt bij een vetrijk dieet. Er zijn echter geen klinische studies beschikbaar die het effect van een vetbeperking op de GERD-symptoomcontrole hebben onderzocht zodat er op basis van de literatuur geen aanbeveling kan worden gedaan over het vetgehalte van de maaltijd.
Patiënten met GERD hebben vaak bovenbuikklachten na de maaltijd (dyspepsie). Aangezien vetrijke maaltijden de maaglediging vertragen en de gevoeligheid van de maag kunnen verhogen, kan zeker bij patiënten met bijkomende dyspepsieklachten een beperking van het vetgehalte worden geadviseerd. Ook in dit geval ontbreekt echter evidentie van interventiestudies (31).
Alcohol
Alcoholische dranken kunnen in theorie GERD bevorderen en reflux veroorzaken door toename van de maagzuurproductie door een gestimuleerde vrijzetting van gastrine, een verminderde druk ter hoogte van de onderste slokdarmsfincter, toegenomen TLESRs en een minder goede slokdarmmotiliteit (32). Het wetenschappelijke bewijs hiervoor is echter beperkt. Alcohol lokte bij GERD-patiënten pyrosis uit en wodka zorgde bij 12 gezonde vrijwilligers voor meer refluxepisodes en symptomen dan water (33,34). Een grote Chinese studie vond een verband tussen overmatig alcoholgebruik en GERD: 43 % van de zware drinkers (meer dan 20 eenheden per week) en maar 16 % van de niet-drinkers rapporteerden refluxklachten (35). Twee andere studies suggereren daarentegen dat alcohol drinken de perceptie van reflux vermindert (36,37). In meerdere cross-sectionele studies kon men evenmin een verband aantonen tussen alcoholconsumptie en reflux (38,39).
Belangrijke kanttekening hierbij is dat bevolkingsstudies gebaseerd zijn op zelfrapportering van het alcoholgebruik wat vaak onderschat wordt. Daarnaast is het moeilijk om in bevolkingsonderzoek een voedingsbestanddeel te identificeren dat slechts bij een subgroep van de patiënten een rol speelt en niet geassocieerd is met andere risicofactoren voor reflux (bv. obesitas, vetrijke voeding).
Rekening houdend met de beperkte beschikbare gegevens lijkt de aanbeveling voor GERD-patiënten om het gebruik van alcohol te matigen gewettigd. De wetenschappelijke evidentie hiervoor is echter beperkt.
Koffie
Koffie wordt vaak geassocieerd met reflux. Dat wordt echter niet ondersteund door wetenschappelijke data. In één studie werd een lagere zuurexpositie van de slokdarm gezien na een gestandaardiseerd ontbijt met koffie zonder cafeïne dan na een met normale koffie (40). In epidemiologische studies en een recente meta-analyse vond men echter geen verband tussen koffie drinken en het optreden van refluxsymptomen (35,38,39,41). Ook hierbij moet rekening worden gehouden met het feit dat zelfrapportering van een voedingspatroon niet altijd betrouwbaar is.
Zure en koolzuurhoudende dranken
Patiënten met pyrosis geven vaak aan dat zure dranken (bv. met citrusvruchten) en koolzuurhoudende dranken klachten uitlokken (33). De zuurtegraad van de dranken correleerde met de mate waarin klachten werden uitgelokt (33). In een oudere studie veroorzaakte pH-geneutraliseerd sinaasappelsap echter ook pyrosis waardoor mogelijk nog andere componenten in deze dranken aanleiding kunnen geven tot symptomen (42). Koolzuurhoudende dranken zijn vaak zuur (bv. pH van ongeveer 2,5 voor cola). Bovendien veroorzaken ze een uitzetting van de maag met sfincterrelaxatie en reflux tot gevolg. In een Amerikaanse studie was het gebruik van koolzuurhoudende frisdranken geassocieerd met nachtelijke pyrosis in een multivariate analyse (43). Een recente systematische review vond echter geen duidelijk effect van koolzuurhoudende dranken op reflux (44). Kortdurende klachten tijdens en vlak na het drinken werden in deze studies evenwel niet in rekening gebracht. Daarom lijkt het voor symptomatische patiënten toch raadzaam om citrusdranken en koolzuurhoudende dranken te beperken.
Chocolade, pikante voeding en uien
Chocolade verlaagt de druk van de onderste slokdarmsfincter en verhoogt de zuurblootstelling in de slokdarm bij patiënten met oesofagitis (45). Er is echter nooit een verband aangetoond met symptomen. Ook bevolkingsonderzoek vond geen verband tussen het gebruik van chocolade en GERD. Chocolade is dus niet verboden voor GERD-patiënten maar zoals voor gezonde personen betaamt een matig gebruik.
Hoewel patiënten pikant voedsel en uien vaak vermelden als uitlokkende factoren voor reflux, zijn er over het effect hiervan slechts anekdotische gegevens beschikbaar. Hierover kunnen dus geen aanbevelingen worden gedaan (32,38).
Besluit
Sinds de beschikbaarheid van krachtige zuurremmende PPIs, is het belang van voedingsmaatregelen bij de behandeling van gastro-oesofageale reflux in de dagelijkse klinische praktijk afgenomen. Bovendien is de wetenschappelijke evidentie voor veel gegeven voedingsadviezen beperkt. Goed voedingsadvies kan echter toch een rol spelen bij patiënten met milde klachten, patiënten die blijvende klachten hebben ondanks een behandeling met PPIs of patiënten die met medicatie wensen te stoppen. Vermageren in geval van overgewicht en geen maaltijden meer nemen laat op de avond zijn wetenschappelijk gefundeerde adviezen. De wetenschappelijke evidentie voor de beperking van vet, alcohol, koffie en zure en koolzuurhoudende dranken is eerder beperkt en meer controversieel. Hierover moet dus op individueel patiëntenniveau worden geoordeeld of het al dan niet relevant is. De relevantie neemt toe bij overmatig gebruik.
- Vakil N, van Zanten SV, Kahrilas P, Dent J, Jones R, Global Consensus G. The Montreal definition and classification of gastroesophageal reflux disease: a global evidence-based consensus. Am J Gastroenterol 2006; 101 (8): 1900-20; quiz 43
- El-Serag HB, Sweet S, Winchester CC, Dent J. Update on the epidemiology of gastro-oesophageal reflux disease: a systematic review. Gut 2014; 63 (6): 871-880
- Herregods TV, Bredenoord AJ, Smout AJ. Pathophysiology of gastroesophageal reflux disease: new understanding in a new era. Neurogastroenterol Motil 2015
- Karamanolis G, Tack J. Nutrition and motility disorders. Best Pract Res Clin Gastroenterol 2006; 20 (3): 485-505
- Corley DA, Kubo A. Body mass index and gastroesophageal reflux disease: a systematic review and meta-analysis. Am J Gastroenterol 2006; 101 (11): 2619-2628
- Singh S, Sharma AN, Murad MH, Buttar NS, El-Serag HB, Katzka DA, et al. Central adiposity is associated with increased risk of esophageal inflammation, metaplasia, and adenocarcinoma: a systematic review and meta-analysis. Clin Gastroenterol Hepatol 2013; 11 (11): 1399-1412 e7
- Pandolfino JE, El-Serag HB, Zhang Q, Shah N, Ghosh SK, Kahrilas PJ. Obesity: a challenge to esophagogastric junction integrity. Gastroenterology 2006; 130 (3): 639-649
- Wu JC, Mui LM, Cheung CM, Chan Y, Sung JJ. Obesity is associated with increased transient lower esophageal sphincter relaxation. Gastroenterology 2007; 132 (3): 883-889
- Lee YY, Wirz AA, Whiting JG, Robertson EV, Smith D, Weir A, et al. Waist belt and central obesity cause partial hiatus hernia and short-segment acid reflux in asymptomatic volunteers. Gut 2014; 63 (7): 1053-1060
- Barcelo M, Alvarez Sanchez A, Garcia Sanchez R, Diaz-Rubio M, Rey E. Weight Gain and Somatization are Associated With the Onset of Gastroesophageal Reflux Diseases: Results of Two 5-year Follow-up Studies. J Clin Gastroenterol 2015
- Ness-Jensen E, Lindam A, Lagergren J, Hveem K. Weight loss and reduction in gastroesophageal reflux. A prospective population-based cohort study: the HUNT study. Am J Gastroenterol 2013; 108 (3): 376-382
- Jacobson BC, Somers SC, Fuchs CS, Kelly CP, Camargo CA, Jr. Body-mass index and symptoms of gastroesophageal reflux in women. N Engl J Med 2006; 354 (22): 2340-2348
- Mathus-Vliegen LM, Tytgat GN. Twenty-four-hour pH measurements in morbid obesity: effects of massive overweight, weight loss and gastric distension. Eur J Gastroenterol Hepatol 1996; 8 (7): 635-640
- Mathus-Vliegen EM, Tygat GN. Gastro-oesophageal reflux in obese subjects: influence of overweight, weight loss and chronic gastric balloon distension. Scand J Gastroenterol 2002; 37 (11): 1246-1252
- Mathus-Vliegen EM, van Weeren M, van Eerten PV. Los function and obesity: the impact of untreated obesity, weight loss, and chronic gastric balloon distension. Digestion 2003; 68 (2-3): 161-168
- Singh M, Lee J, Gupta N, Gaddam S, Smith BK, Wani SB, et al. Weight loss can lead to resolution of gastroesophageal reflux disease symptoms: a prospective intervention trial. Obesity 2013; 21 (2): 284-290
- Kjellin A, Ramel S, Rossner S, Thor K. Gastroesophageal reflux in obese patients is not reduced by weight reduction. Scand J Gastroenterol 1996; 31 (11): 1047-1051
- Cremonini F, Locke GR, 3rd, Schleck CD, Zinsmeister AR, Talley NJ. Relationship between upper gastrointestinal symptoms and changes in body weight in a population-based cohort. Neurogastroenterol Motil 2006; 18 (11): 987-994
- Dent J, Dodds WJ, Friedman RH, Sekiguchi T, Hogan WJ, Arndorfer RC, et al. Mechanism of gastroesophageal reflux in recumbent asymptomatic human subjects. J Clin Invest 1980; 65 (2): 256-267
- DeVault KR, Castell DO, American College of G. Updated guidelines for the diagnosis and treatment of gastroesophageal reflux disease. Am J Gastroenterol 2005; 100 (1): 190-200
- Piesman M, Hwang I, Maydonovitch C, Wong RK. Nocturnal reflux episodes following the administration of a standardized meal. Does timing matter? Am J Gastroenterol 2007; 102 (10): 2128-2134
- Fujiwara Y, Machida A, Watanabe Y, Shiba M, Tominaga K, Watanabe T, et al. Association between dinner-to-bed time and gastro-esophageal reflux disease. Am J Gastroenterol 2005; 100 (12): 2633-2636
- Yang JH, Kang HS, Lee SY, Kim JH, Sung IK, Park HS, et al. Recurrence of gastroesophageal reflux disease correlated with a short dinner-to-bedtime interval. J Gastroenterol Hepatol 2014; 29 (4): 730-735
- Wu KL, Rayner CK, Chuah SK, Chiu YC, Chiu KW, Hu TH, et al. Effect of liquid meals with different volumes on gastroesophageal reflux disease. J Gastroenterol Hepatol 2014; 29 (3): 469-473
- Valitova ER, Bayrakci B, Bor S. The effect of the speed of eating on acid reflux and symptoms of patients with gastroesophageal reflux disease. The Turkish journal of gastroenterology : the official journal of Turkish Society of Gastroenterology 2013; 24 (5): 379-381
- El-Serag HB, Satia JA, Rabeneck L. Dietary intake and the risk of gastro-oesophageal reflux disease: a cross sectional study in volunteers. Gut 2005; 54 (1): 11-17
- Nebel OT, Castell DO. Inhibition of the lower oesophageal sphincter by fat--a mechanism for fatty food intolerance. Gut 1973; 14 (4): 270-274
- Becker DJ, Sinclair J, Castell DO, Wu WC. A comparison of high and low fat meals on postprandial esophageal acid exposure. Am J Gastroenterol 1989; 84 (7): 782-786
- Penagini R, Mangano M, Bianchi PA. Effect of increasing the fat content but not the energy load of a meal on gastro-oesophageal reflux and lower oesophageal sphincter motor function. Gut 1998; 42 (3): 330-333
- Fox M, Barr C, Nolan S, Lomer M, Anggiansah A, Wong T. The effects of dietary fat and calorie density on esophageal acid exposure and reflux symptoms. Clin Gastroenterol Hepatol 2007; 5(4): 439-444
- Feinle-Bisset C, Azpiroz F. Dietary lipids and functional gastrointestinal disorders. Am J Gastroenterol 2013; 108 (5): 737-747
- Kang JH, Kang JY. Lifestyle measures in the management of gastro-oesophageal reflux disease: clinical and pathophysiological considerations. Therapeutic advances in chronic disease 2015; 6(2): 51-64
- Feldman M, Barnett C. Relationships between the acidity and osmolality of popular beverages and reported postprandial heartburn. Gastroenterology 1995; 108 (1): 125-131
- Kaufman SE, Kaye MD. Induction of gastro-oesophageal reflux by alcohol. Gut 1978; 19 (4): 336-338
- Wang JH, Luo JY, Dong L, Gong J, Tong M. Epidemiology of gastroesophageal reflux disease: a general population-based study in Xi'an of Northwest China. World J Gastroenterol 2004; 10 (11): 1647-1651
- Shapiro M, Green C, Bautista JM, Dekel R, Risner-Adler S, Whitacre R, et al. Assessment of dietary nutrients that influence perception of intra-oesophageal acid reflux events in patients with gastro-oesophageal reflux disease. Aliment Pharmacol Ther 2007; 25 (1): 93-101
- Reding KW, Cain KC, Jarrett ME, Eugenio MD, Heitkemper MM. Relationship between patterns of alcohol consumption and gastrointestinal symptoms among patients with irritable bowel syndrome. Am J Gastroenterol 2013; 108 (2): 270-276
- Pandeya N, Green AC, Whiteman DC, Australian Cancer S. Prevalence and determinants of frequent gastroesophageal reflux symptoms in the Australian community. Dis Esophagus 2012; 25 (7): 573-583
- Stanghellini V. Relationship between upper gastrointestinal symptoms and lifestyle, psychosocial factors and comorbidity in the general population: results from the Domestic/International Gastroenterology Surveillance Study (DIGEST). Scandinavian journal of gastroenterology Supplement 1999; 231: 29-37
- Pehl C, Pfeiffer A, Wendl B, Kaess H. The effect of decaffeination of coffee on gastro-oesophageal reflux in patients with reflux disease. Aliment Pharmacol Ther 1997; 11 (3): 483-486
- Kim J, Oh SW, Myung SK, Kwon H, Lee C, Yun JM, et al. Association between coffee intake and gastroesophageal reflux disease: a meta-analysis. Dis Esophagus 2014; 27 (4): 311-317
- Price SF, Smithson KW, Castell DO. Food sensitivity in reflux esophagitis. Gastroenterology 1978; 75 (2): 240-243
- Fass R, Quan SF, O'Connor GT, Ervin A, Iber C. Predictors of heartburn during sleep in a large prospective cohort study. Chest 2005; 127 (5): 1658-1666
- Johnson T, Gerson L, Hershcovici T, Stave C, Fass R. Systematic review: the effects of carbonated beverages on gastro-oesophageal reflux disease. Aliment Pharmacol Ther 2010; 31 (6): 607-614
- Murphy DW, Castell DO. Chocolate and heartburn: evidence of increased esophageal acid exposure after chocolate ingestion. Am J Gastroenterol 1988; 83 (6): 633-636
Belangenconflict
Geen



